細胞焦亡是機體通過免疫反應抑製腫瘤發生和發展的重要途徑,而異常的細胞焦亡則會製約多種腫瘤療法的實施。一些腫瘤細胞通過抑製焦亡相關基因表達或激活負調節通路,使其抗化療藥物能力增強[1];但在藥物化療和CAR-T療法中,腫瘤免疫造成的過度細胞焦亡會造成正常組織的損傷甚至產生細胞因子風暴(CRS)等[2,3]。
GSDME是腫瘤細胞發生焦亡時的關鍵執行蛋白,受上遊Caspase-3蛋白剪切激活,並在細胞膜上形成破壞性的孔洞狀結構,引起細胞的死亡、破裂與炎症因子的釋放[4]。在發生凋亡過程的細胞中,若有內源GSDME高表達,會使細胞死亡方式由凋亡轉為焦亡[2]。細胞內GSDME的表達量水平,很多情況下會對細胞的存活率和死亡方式起決定性作用。因此,探究GSDME的表達調控機製,對深入理解細胞程序性死亡進程,對改善腫瘤治療的臨床療效和尋找新的治療靶點有重要意義。
2024年1月,万博英超狼队网官方网 李繼喜教授團隊在《Cell Death & Disease》雜誌在線發表了題為Transcription factor Sp1 transcriptionally enhances GSDME expression for pyroptosis的研究論文。該研究通過實驗證明了腫瘤細胞中,轉錄因子Sp1結合GSDME啟動子區域,激活GSDME的表達。對於這條通路的抑製可以增強腫瘤細胞對化療藥物的抵抗作用,並且該機製與STAT3轉錄調控通路有協作關係,與DNA甲基化有拮抗關係,揭示了Sp1在程序性死亡過程中的重要功能。

轉錄因子Sp1是一種直接結合啟動子高GC含量元件的蛋白,其在細胞增殖和死亡過程中調控多種重要基因的表達。研究團隊利用熒光素酶報告基因係統,通過截短GSDME啟動子,鎖定了啟動子-50~+1區是維持啟動活性的關鍵區域,並發現-36~-28區是轉錄因子Sp1的結合位點,對該位點進行突變會顯著降低下遊基因的表達效率。與此同時,對HeLa細胞內Sp1的敲低或過表達分別抑製或提高GSDME的mRNA和蛋白水平;藥物抑製也可以劑量依賴性的降低肝癌細胞係Huh7中GSDME表達。
因為GSDME是導致細胞焦亡的關鍵蛋白,作者繼續探究Sp1功能對細胞命運的調控。發現在HeLa細胞中,Sp1的敲低或藥物抑製減少了GSDME的表達,由此減少了在焦亡發生時有細胞毒性的GSDME的N末端含量。因此在受到化療藥物拓撲替康、依托泊苷和阿黴素刺激時,HeLa細胞的死亡率和細胞內容物釋放量都顯著減少,Sp1的藥物抑製也增強了Huh7細胞係對順鉑和索拉非尼的藥物抗性。形態學觀測發現,Sp1敲低的細胞在死亡時細胞由產生吐泡結構的焦亡形態轉變為富含密集凋亡小體的凋亡形態。以上結果都說明Sp1調控GSDME表達的機製對腫瘤細胞的藥物敏感性以及死亡方式決定關係重大。
接下來,作者驗證了Sp1與目前已有報道的GSDME表達調控機製之間的關係[5,6]。發現Sp1與轉錄因子STAT3的共同敲低能更明顯的降低GSDME表達和提高細胞耐藥性,說明二者之間的協同作用。而DNA甲基化則可以在Sp1結合的啟動子位點附近形成空間位阻,抑製Sp1的轉錄啟動活性。最後,通過mRNA和蛋白水平的檢測,作者發現Sp1的敲低和藥物抑製並不影響傳統的GSDMD介導的焦亡方式或RIP3-MLKL介導的程序性壞死通路,說明了Sp1更偏好於對GSDME焦亡通路的影響。
綜上所述,該研究揭示了轉錄因子Sp1通過促進GSDME的轉錄表達,提高了細胞在刺激條件下的焦亡水平及對化療藥物的敏感性。為探究細胞程序性死亡調控機製提供了更深入的信息,為腫瘤藥物開發提供了新的靶點。
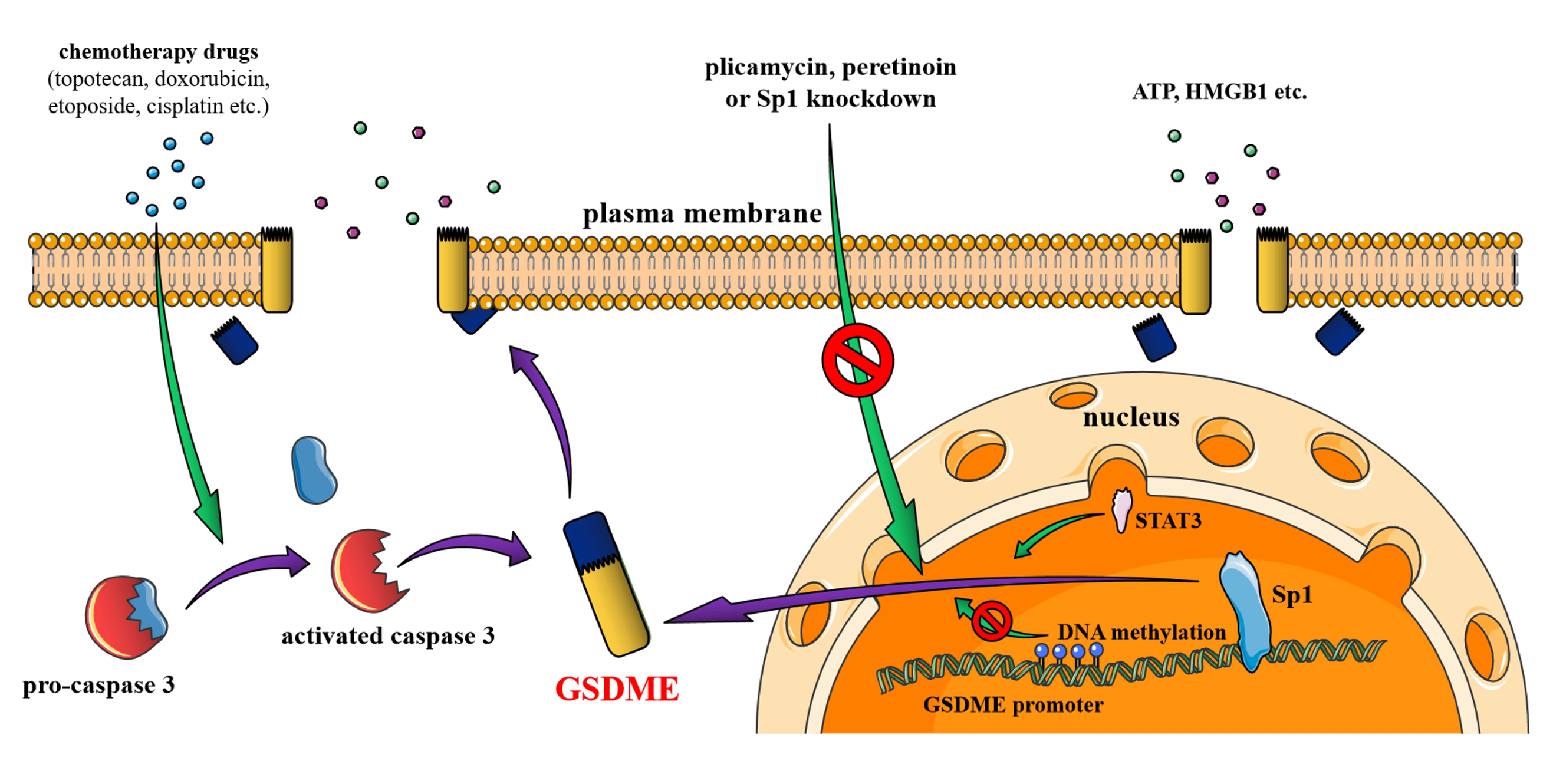
圖1,轉錄因子Sp1調控GSDME模式圖。
万博英超狼队网官方网 博士生潘佳鬆為該論文的第一作者,狗万外围充值 李繼喜教授和昆山杜克大學李素華藥學博士為論文共同通訊作者。海軍軍醫大學丁勁教授提供了指導和幫助。研究工作得到了國家自然科學基金委和科技部國家重點研發計劃項目的支持。
原文鏈接:https://www.nature.com/articles/s41419-024-06455-6
參考文獻
Zhang Z, Zhang Y, Xia S, Kong Q, Li S, Liu X, et al. Gasdermin E suppresses tumour growth by activating anti-tumour immunity. Nature. 2020;579:415–20.
Wang Y, Gao W, Shi X, Ding J, Liu W, He H, et al. Chemotherapy drugs induce pyroptosis through caspase 3 cleavage of a gasdermin. Nature. 2017;547:99–103.
Liu Y, Fang Y, Chen X, Wang Z, Liang X, Zhang T, et al. Gasdermin E-mediated target cell pyroptosis by CAR T cells triggers cytokine release syndrome. Sci Immunol. 2020;5:eaax7969.
Galluzzi L, Vitale I, Aaronson SA, Abrams JM, Adam D, Agostinis P, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018;25:486–541.
Wei Y, Lan B, Zheng T, Yang L, Zhang X, Cheng L, et al. GSDME-mediated pyroptosis promotes the progression and associated inflammation of atherosclerosis. Nat Commun. 2023;14:929.
Croes L, Beyens M, Fransen E, Ibrahim J, Vanden Berghe W, Suls A, et al. Large-scale analysis of DFNA5 methylation reveals its potential as biomarker for breast cancer. Clin Epigenetics. 2018;10:51.

