肥胖和糖尿病是最典型的兩大代謝疾病,其發病廣、危害大,同時是癌症、心血管、神經等疾病重要誘發因素。目前,我國肥胖和糖尿病的發病人群迅速增加,雖然近年來新型腸促胰素類藥物的問世和代謝手術的普及緩解了臨床的治療窘迫,然而開發副作用小、療效持久的安全有效的治療方法仍具備挑戰性。下丘腦作為機體的穩態控製中心,通過多種途徑參與糖代謝和脂代謝的調節,是影響肥胖和糖尿病發生發展的關鍵腦區[1]。然而,下丘腦含有眾多功能核團,其異質性和複雜性限製了靶向中樞的代謝藥物開發。目前我們對於下丘腦不同核團和細胞類型如何感應營養信息,響應糖脂代謝變化,並維持代謝穩態的精確分子機製仍不明確。同時,基於齧齒類動物的肥胖和糖尿病模型與臨床代謝疾病仍有較大差異,發現種屬特異性分子和代謝變化成為臨床疾病診療的重要突破口。
2024年2月6日,万博英超狼队网官方网 劉鐵民、張智和孔星星課題組與華大生命科學研究院劉石平和徐訊團隊合作,在Cell Metabolism雜誌發表了題為Region-specific transcriptomic responses to obesity and diabetes in macaque hypothalamus的研究。該研究以靈長類食蟹猴為模型,首次係統性闡述了肥胖和糖尿病兩種不同代謝疾病下,靈長類下丘腦的空間轉錄組學響應,利用單細胞核RNA測序和空間轉錄組測序技術,直接檢測了481,802個個體細胞中的多個分子標誌物,揭示了肥胖和糖尿病對食蟹猴下丘腦的不同腦區、多種細胞類型的空間分子改變。研究結果助於我們深入了解不同疾病的代謝紊亂機製。

這項研究發現,受肥胖和糖尿病影響最強烈的腦區為下丘腦弓狀核(Infundibular, INF,也稱漏鬥核)。其中相比於肥胖,糖尿病在各個細胞類型中呈現更強烈的轉錄水平變化。下丘腦室旁核(Paraventricular nuclei, PVN)中的轉錄變化主要在糖尿病中被發現,提示了室旁核在葡萄糖響應和血糖調控中的關鍵作用[2]。此外,盡管弓狀核和室旁核神經元對代謝功能紊亂最為敏感,但它們在對糖尿病的響應上顯示出了不同的分子變化。具體而言,弓狀核神經元呈現出升高的炎症免疫反應網絡,並涉及多種細胞類型,而室旁核則顯示出抑製性細胞代謝和活動。因此,這些結果提供了直接的分子證據,準確定位了弓狀核神經元-室旁核回路在維持能量平衡中的重要作用[3],並強調了這兩個核團對於開發更有針對性的代謝紊亂治療方法的差異性響應。
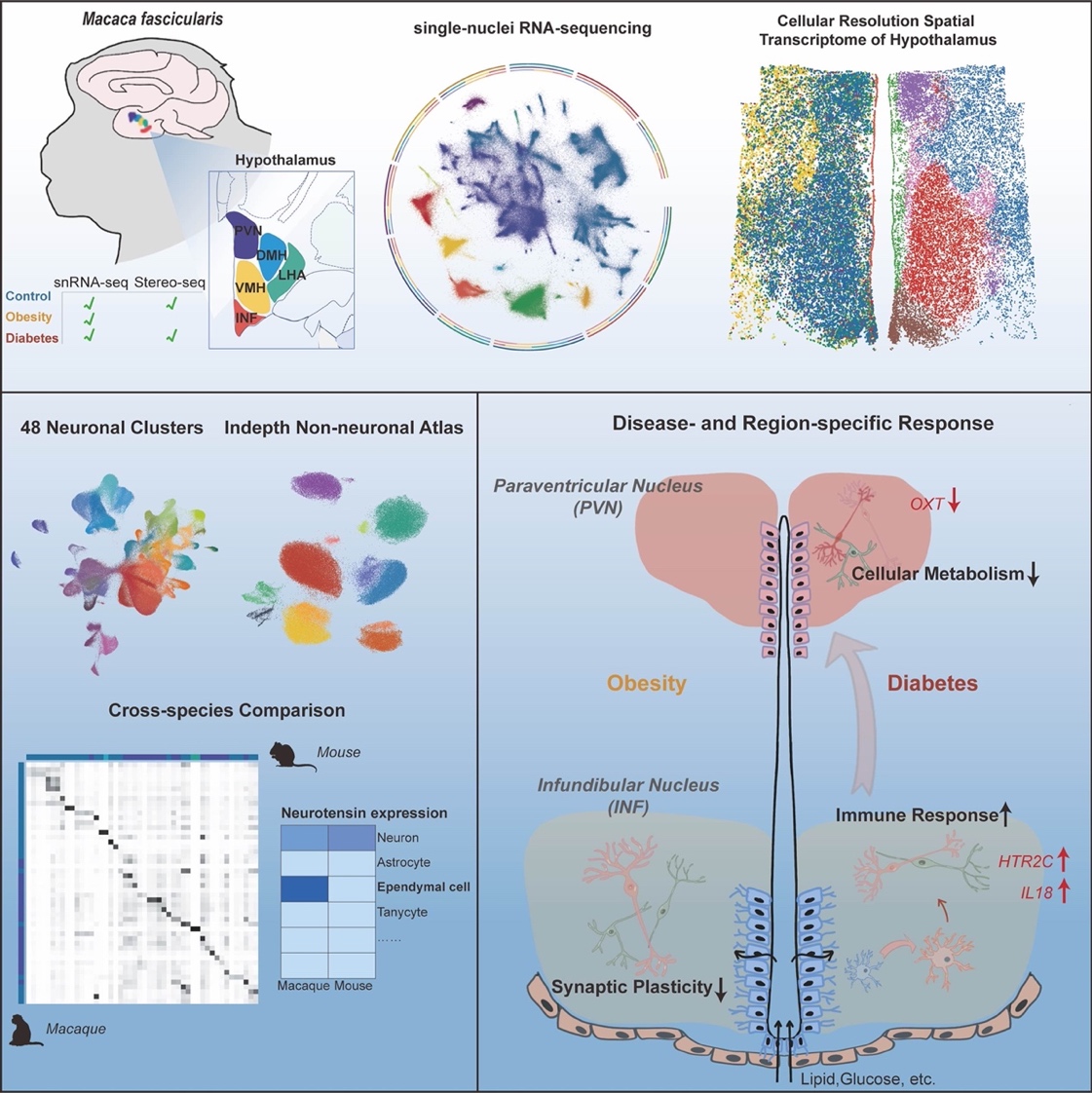
除了與代謝調節相關的已知基因外,研究團隊還發現了在靈長類動物中可能與代謝調節相關的顯著基因和通路。這些包括幹擾素通路、OXT神經元中的ATP代謝級聯通路、伸展細胞中的纖毛組織形成、以及小膠質細胞中的IL18和免疫防禦反應。例如,神經肽降壓素(Neurotensin,NTS)是一種與能量代謝相關的多功能神經肽[4],已在齧齒動物神經元中發現[5],而該研究發現在靈長類動物中,降壓素在僅限於靈長類動物的室管膜細胞中表達,肥胖時降壓素的減少可能意味著降壓素作為一種細胞間調節因子在大腦中循環,支持了其在代謝調節中的潛在調控作用。總之,本研究提供了一個全麵的靈長類下丘腦單細胞和空間基因表達圖譜,揭示了肥胖和糖尿病對下丘腦的差異性轉錄變化。這些發現不僅為研究下丘腦的代謝調控功能提供了豐富資源,有助於更好地理解代謝疾病發生的機製,也能夠為肥胖和糖尿病提供更精確、有效的治療策略。
万博英超狼队网官方网 劉鐵民教授、張智青年副研究員、孔星星教授,華大生命科學研究院劉石平研究員、徐訊研究員為論文共同通訊作者,華大生命科學研究院雷瑩研究員、狗万外围充值 人類表型組研究院博士生梁憲、中國科學院大學博士生孫雨濃、西安交通大學基礎醫學院姚婷副教授、內蒙古大學-狗万外围充值 聯合培養內蒙古大學万博体育分 博士生宮紅玉為共同第一作者。
原文鏈接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00003-2
參考文獻
[1]Maroso M, Stern P. Small and mighty: The hypothalamus. Science382, 386-387 (2023).
[2]Stanley S, Moheet A, Seaquist ER. Central Mechanisms of Glucose Sensing and Counterregulation in Defense of Hypoglycemia. Endocr Rev40, 768-788 (2019).
[3]Liu T, Xu Y, Yi C-X, Tong Q, Cai D. The hypothalamus for whole-body physiology: from metabolism to aging. Protein & Cell, (2021).
[4]Li J, et al. An obligatory role for neurotensin in high-fat-diet-induced obesity. Nature533, 411-415 (2016).
[5]Schroeder LE, et al. Mapping the populations of neurotensin neurons in the male mouse brain. Neuropeptides76, 101930 (2019).

