細胞焦亡(pyroptosis)是機體應對病原體感染的重要炎症性死亡方式,但其過度激活可能導致敗血症等致命性炎症損傷。RING1作為多梳抑製複合物PRC1的核心組分,在表觀遺傳調控中發揮關鍵作用,但在炎症與感染中的功能尚不明確。2025年5月14日,狗万外围充值 李繼喜教授團隊在《Cell Death & Differentiation 》雜誌發表了題為“RING1 dictates GSDMD-mediated inflammatory response and host susceptibility to pathogen infection”的研究論文。該研究首次揭示RING1通過泛素化降解焦亡關鍵蛋白GSDMD,調控宿主對病原體感染的炎症反應。

本研究發現,RING1通過直接結合焦亡執行蛋白GSDMD,催化其第168和203位賴氨酸的K48連接型泛素化修飾,促進蛋白酶體依賴的降解,從而抑製細胞焦亡及IL-1β等炎症因子釋放。動物實驗表明,RING1基因缺失會顯著加劇脂多糖(LPS)誘導的敗血症死亡率,並導致沙門氏菌感染後脾髒細菌載量升高;在結核杆菌感染模型中,RING1缺失雖在早期促進病原體清除,但後期卻加重肺部炎症擴散。研究進一步利用小分子抑製劑阻斷RING1泛素連接酶活性,證實其通過降解GSDMD調控焦亡的分子機製,為靶向幹預提供了實驗依據。
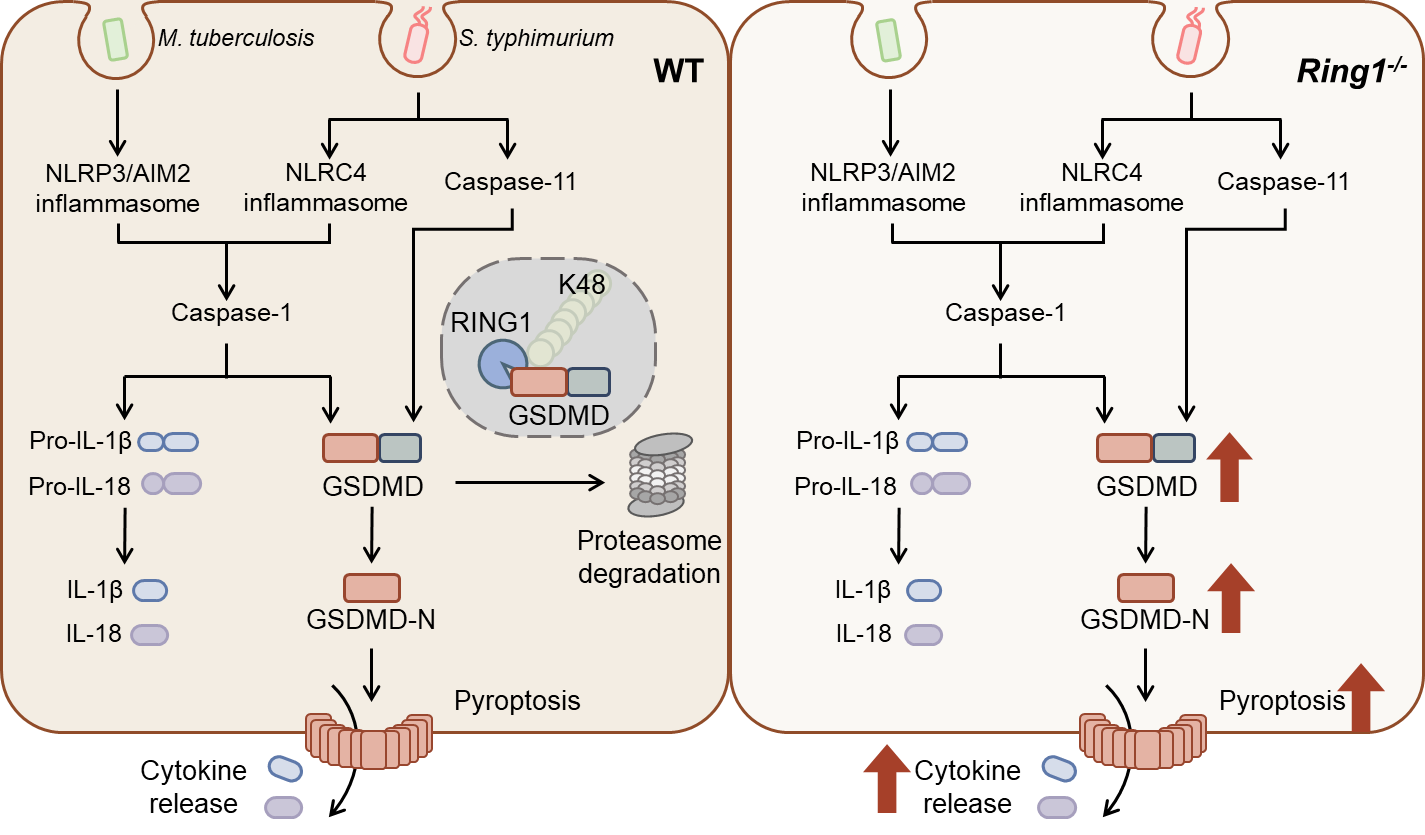
圖1. RING1泛素化降解GSDMD並抑製細胞焦亡的分子機製
李繼喜課題組長期致力於細胞死亡與免疫應答研究。在細胞焦亡領域,通過X-光晶體衍射的結構生物學方法解析了GSDMD-C的精細三維結構,闡明了GSDMD蛋白的自抑製結構基礎(2017,Proc Natl Acad Sci USA)。係統揭示了泛素連接酶TRIM21(2021, Cell Death Differ)、TRIM25(2022, Cell Death Differ)以及轉錄因子SP1(2024, Cell Death Dis)等關鍵分子在程序性細胞死亡中的動態調控機製。
万博英超狼队网官方网 李媛媛博士、高文青博士和博士生邱雨欣為本文共同一作,李繼喜教授為論文通訊作者。研究工作得到了國家自然科學基金委和上海市科委的支持。
論文鏈接:https://www.nature.com/articles/s41418-025-01527-2

