麻錦彪/甘建華課題組合作解析two-barrel家族中RNA聚合酶QDE-1雙重活性分子機製
2022年8月30日,國際期刊《Nucleic Acids Research》在線發布了本院麻錦彪教授、甘建華研究員課題組合作的研究成果,標題為“Structural insights into the dual activities of the two-barrel RNA polymerase QDE-1”。
在植物、真菌和線蟲中,都有一類細胞內來源的RNA依賴的RNA聚合酶(RdRP),能夠將單鏈RNA轉變成雙鏈小幹擾RNA前體。粗糙脈孢菌(Neurospora crassa)的QDE-1是two-barrel超級族聚合酶的成員之一,也是第一個被分離並鑒定參與RNAi的RdRP蛋白,它具有DNA和RNA模板依賴的RNA合成的(DdRP和RdRP)雙重活性,對RNAi過程中的小幹擾RNA前體的產生至關重要。除QDE-1外,這類two-barrels家族蛋白還包括多亞基DdRP蛋白pol II,單亞基Cellulophage baltica crAss-like phage 14:2的DdRP蛋白gp66,古菌DNA複製酶PolD。在這些酶中,擬南芥RDR6具有DdRP活性,而Saccharomyces cerevisiae的pol II有RdRP活性,表明two-barrel聚合酶超級族能夠以DNA或RNA為模板的內在特性。但目前缺少高分辨的蛋白-底物複核物結構,尤其是參與RNAi的RdRP蛋白尚無任何複合物結構報道,two-barrels聚合酶超家族蛋白與DNA/RNA模板的結合及產生RNA的分子機製的研究仍很不明確。
在本研究中,共解析了五種QDE-1與不同底物在不同反應狀態的複合物結構:DNA/RNA為模板的延伸複合物(EC),從頭合成起始複合物(IC),初始NTP加載以及包含兩個起始NTP的結構。模板鏈(DNA或RNA)通過bridge-helix (BH)和double-psi beta-barrels 2(DPBB2)排列到蛋白活性口袋內。RNA產物則被DPBB1和Slab結構域穩定。DNA模板在-7位與RNA產物分離,但RNA模板仍保持匹配。NTP類似物在活性中心處被一個剛性的trigger loop (TL)和一個脯氨Pro-Gate loop精準定位到NTP addition site,並參與了金屬離子的配位(圖1)。此外,在本研究中還發現QDE-1二聚體中一個單體的 C末端尾巴插入到互作分子的的底物結合口袋,在RNA合成過程中起到調節作用(圖2)。總之,這項工作詳細闡明了QDE-1以及其它two-barrel超級族聚合酶的DNA/RNA依賴的雙重活性的保守機製。
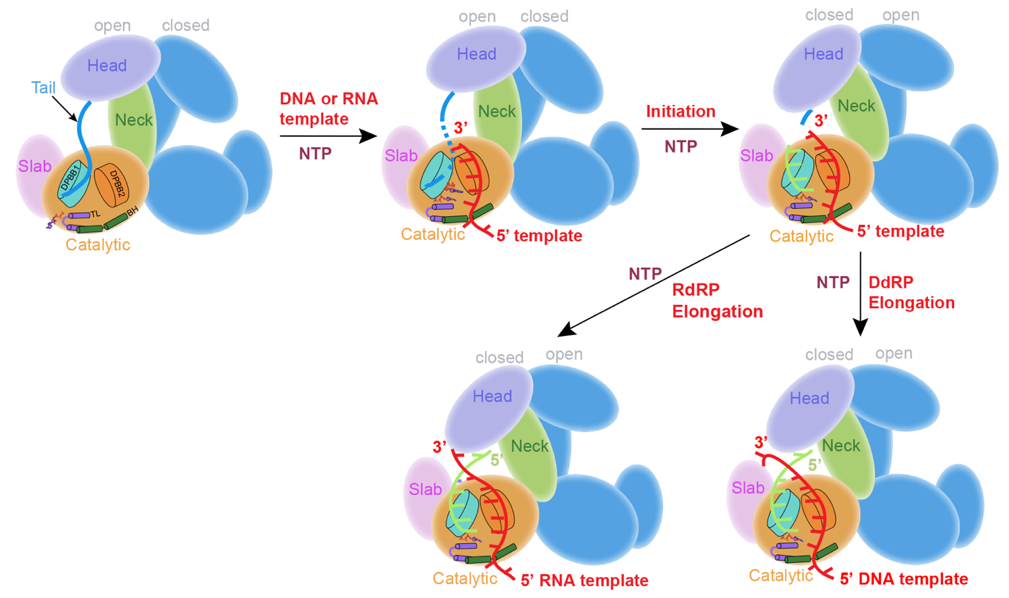
圖1. QDE-1通過DdRP/RdRP雙重活性生成RNA的分子機製
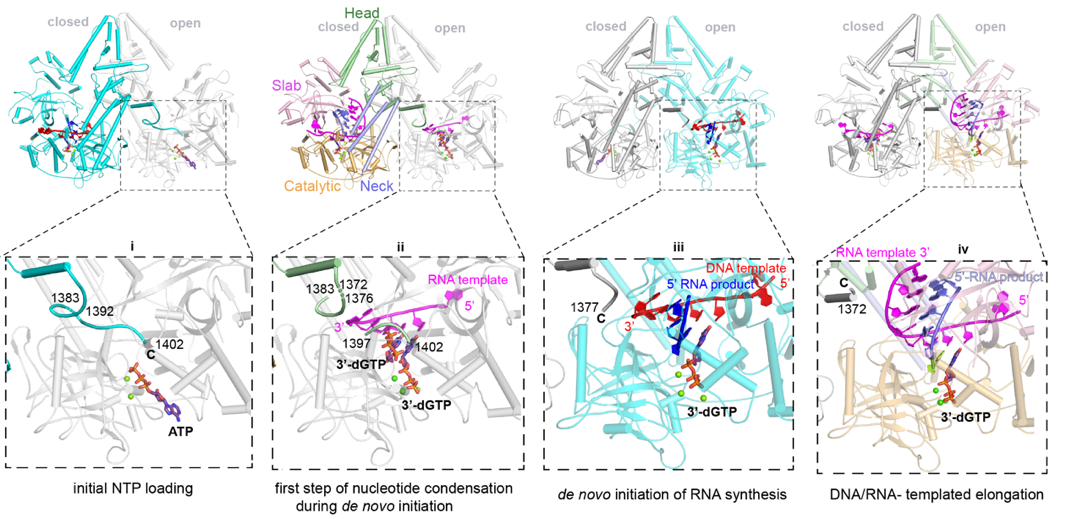
圖2. QDE-1的C末端尾巴在不同反應狀態的動態構象變化
狗万外围充值 麻錦彪課題組崔瑞雪博士為論文第一作者,碩士研究生李皓、趙進和本科生李旭航也參與了本課題的研究。麻錦彪教授、甘建華研究院為共同通訊作者。上海同步輻射光源提供了X-射線衍射設施。研究獲得了國家自然科學基金(31971130)和重點研發項目(2018YFC1003801)的資助。
論文鏈接:https://doi.org/10.1093/nar/gkac727

